篇一:【化学】黑龙江省双鸭山市第一中学2016届高三上学期12月月考试题化学
双鸭山一中2015年高三月考化学考试题
可能用到的相对原子质量:H:1C:12N:14O:16Mg:24Al:27 S:32K:39Fe:56Cu:64Zn:65Ag:108Ba:137
I卷(25个选择题,共75分)
一、单项选择题(每小题只一个正确答案,每题3分,共75分) 1.下列说法不正确的是() ...
A.胶体的分散质粒子直径大小介于溶液与浊液之间 B.金属冶炼通常利用氧化还原反应原理 C.陶瓷、水泥和光导纤维均属于硅酸盐材料
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 2.72号元素所在周期和族是( )
A.第六周期ⅣB族 B.第六周期ⅢB族 C.第六周期0族
D.第六周期ⅢA族
3.NA代表阿伏加德罗常数的数值,下列说法正确的是() A.1molFeCl3完全水解生成NA个胶体粒子 B.常温常压下,23gNO2分子总数小于0.5NA
C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA D.6.8g熔融态KHSO4中含有0.1NA个阳离子 4.下列排列顺序正确的是()
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③沸点:H2Se>H2S>H2O ④结合H+能力:OH>CH3COO>I
-
-
-
A.①③ B.②③ C.①④ D.②④
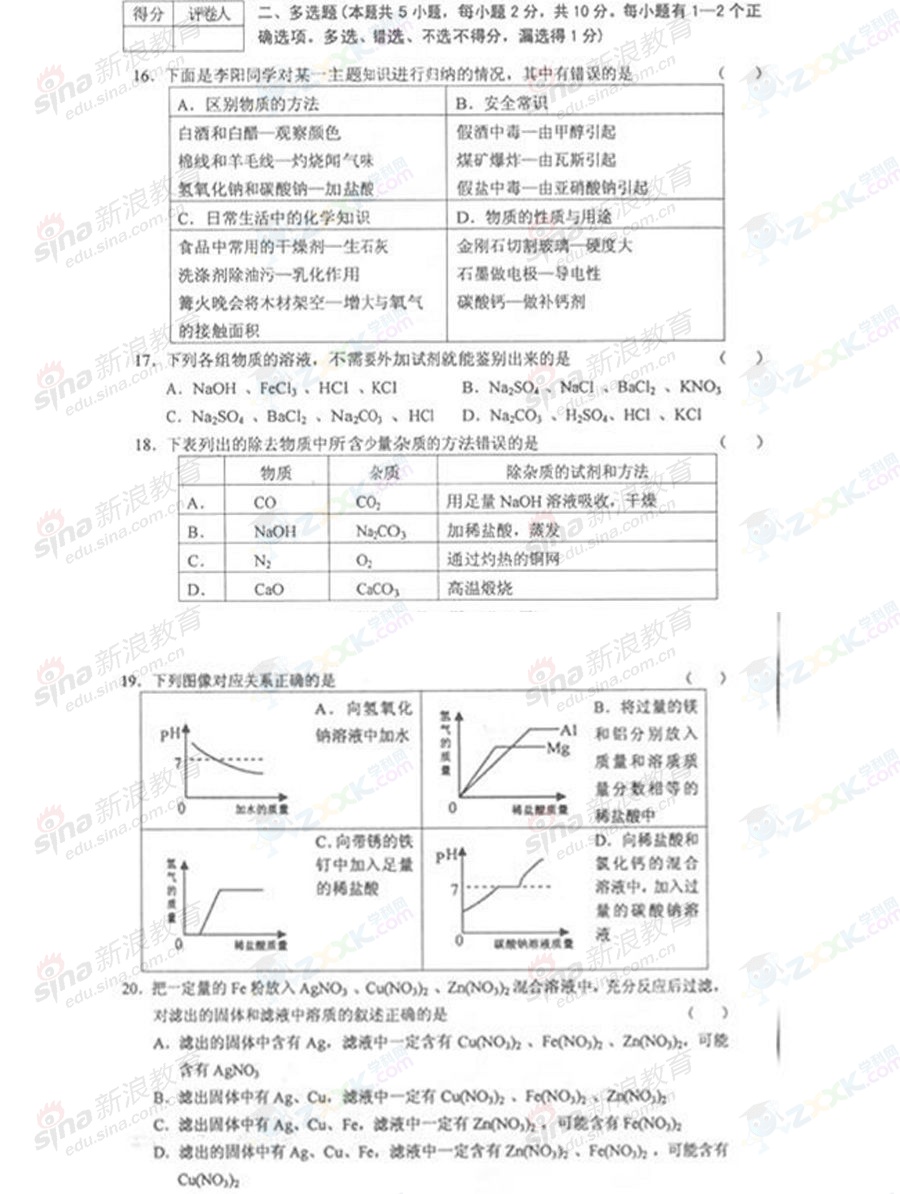
3+5.VmLAl(2SO4)3溶液中含有Alag,取
-
1
VmL溶液稀释到4VmL,则稀释后溶液中S0424
的物质的量浓度是()
A.
125a125a125a125a
mol/LB.mol/LC.mol/LD.mol/L 9V18V36V54V
6.下列说法不正确的是()
①将BaSO4放入水中不能导电,所以BaSO4是非电解质 ②氨溶于水得到的氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电 ④固态的离子化合物不导电,熔融态的离子化合物也不导电 ⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 A.①④B.①④⑤C.①②③④D.①②③④⑤
7.室温下,下列各组离子能大量共存的是() A.稀硫酸中:K、Mg2+、AlO2、S2O32
+
-
-
B.Na2S溶液中:SO42-、K、Cl、Cu2
+
-
+
Kw+-13
C.L-1溶液中:Fe3+、NH4、Mg2+、SO42-?=10mol·
c(H)
-
-
-
D.通入大量CO2的溶液中:Na+、ClO、CH3COO、HCO3 8.下列离子方程式书写正确的是()
A.过量的CO2通入NaOH溶液中:CO2+2OH=CO32+H2O
-
-
B.氨水中通入过量CO2:2NH3·H2O+CO2=2NH4++CO32—+H2O
C.饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O D.NaHCO3溶液中加入过量的Ca(OH)2溶液: 2HCO3+Ca2+2OH=CaCO3↓+2H2O+CO32
-
+
-
-
9.下列物质的制备方法正确的是()
A.氯化铝溶液和硫化钠溶液反应制备Al2S3B.用镁粉和空气反应制备Mg3N2 C.用铝粉和MnO2制得锰D.用电解熔融氯化铝的方法制得单质铝
10.一未完成的离子方程式:________+XO3+6H===3X2+3H2O,据此判断下列说法 正确的是()
A.X原子最外层有5个电子
B.当有1molX2生成时,共有2mol电子转移 C.氧化产物和还原产物的物质的量之比为5∶1
D.“_____”上所填的微粒和XO3在任何环境下都不能共存
11.将两粒相同大小的钠,一粒用铝箔包好为甲,另一粒为乙,将甲、乙两粒钠分别投入足量的水中,收集所得气体,气体的体积大小关系是() A.甲多B.乙多C.一样多D.无法确定
12.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4②H2SO3 ③NaHSO3④Na2S,所含带电微粒的数目由多到少的顺序是() A.①=④>③=② C.①>④>③>②
B.①=④>③>② D.④>①>③>②
-
-
+
13.已知NH4CuSO3与足量的10mol/L硫酸液混合微热,有下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。下列说法正确的是() A、反应中硫酸作氧化剂B、NH4CuSO3中硫元素被氧化
C、刺激性气味的气体是氨气D、1molNH4CuSO3完全反应转移0.5mol电子
14.含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子或物质)沉淀pH见下表)()
15.某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L1,含有硝酸的浓度为
-
1mol·L1,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标
-
准状况下的气体的体积为( )
A.224mLB.168mLC.112mLD.448mL
16.在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是 A.Fe2S3、I2
B.Al(OH)3、I2
()
C.Fe(OH)3、Al(OH)3D.FeS、S、Al(OH)3
17.下列有关说法正确的是()
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 B.反应A(g)
2B(g);若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,
则该反应的△H=(Ea-Eb)kJ·mol-1。 C.N2(g)+3H2(g
)
率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0
18.将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为: A.9B.10C.11D.12()
19.控制适合的条件,将反应Fe3+Ag
+
2NH3(g)ΔH<0,其他条件不变时升高温度,平衡时氢气转化
Fe2+Ag设计成如图
+
+
所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居
中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是() A.盐桥中的K移向乙烧杯
B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 C.在外电路中,电子从石墨电极流向银电极
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 20.可逆反应mA(g)+nB(g)
pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,
+
只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大.以上所述正确的为( ) A.②④⑤⑦ B.②④⑥⑧C.②③⑤⑦ D.②④⑤⑧
21.设某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,且X>11将上述两溶液分别取等体积充分混合,混合液中各离子的浓度由大到小的顺序是() A.c(Cl)?c(NH4+)?c(H)?c(OH)
-
+
-
B.c(NH4+)?c(Cl)?c(H)?c(OH)
-
+
-
C.c(NH4+)?c(Cl)?c(OH)?c(H)
-
-
+
D.c(Cl)?c(NH4+)?c(OH)?c(H)
-
-
+
22.某温度下,向2L恒容密闭容器中充入1.0molA和1.0molB,反应: A(g)+B(g)
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见
下表,下列说法正确的是( )
A.
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol·L1,则反应的ΔH>0
-
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80% D.相同温度下,起始时向容器中充入0.20molA、0.20molB和1.0molC,反应达到平衡前v(正)<v(逆)
23.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是() ①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低 ②pH=2的盐酸和pH=1的盐酸,c(H)之比为2:1 ?
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa;c.NaHCO3;d.NaOH.
其溶液物质的量浓度由小到大顺序为d、b、c、a
2?
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na?)?2c(SO4)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为
Ka?Kh?Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7 A.③⑤⑥
B.③④⑥
-1
C.④⑤⑥ D.①②④
-1
24.室温下,向20.00mL1.000mol·L氨水中滴入1.000mol·L盐酸,溶液pH和温度随加
入盐酸体积变化曲线如右图所示。下列有关说法错误的是( )
102(a?14)
mol.L?1 A.室温下,a点的氨水电离常数为(a?14)
1?10
B.将此氨水稀释,溶液的导电能力减弱 C.c点时消耗盐酸体积V(HCl)<20mL D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
25.将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体在标准状况的体积为() A.4.48LB.5.6LC.6.72LD.7.84L II卷(包含4道大题,共45分) 二.填空
26.(9分)已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。
(1)F的俗名是,B分子的结构式为________工业上利用反应③生 产。
篇二:黑龙江省双鸭山市中考真题
篇三:黑龙江省双鸭山市第一中学2016届高三化学上学期12月月考试题
双鸭山一中2015年高三月考化学考试题
可能用到的相对原子质量:H:1C:12N:14O:16 Mg:24Al:27S:32K:39 Fe: 56 Cu:64Zn:65 Ag: 108Ba:137
I卷(25个选择题,共75分)
一、单项选择题(每小题只一个正确答案,每题3分,共75分)
1.下列说法不正确的是 ( ) ...
A.胶体的分散质粒子直径大小介于溶液与浊液之间
B.金属冶炼通常利用氧化还原反应原理
C.陶瓷、水泥和光导纤维均属于硅酸盐材料
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
2.72号元素所在周期和族是( )
A.第六周期ⅣB族 B.第六周期ⅢB族
C.第六周期0族D.第六周期ⅢA族
3.NA代表阿伏加德罗常数的数值,下列说法正确的是 ( )
A. 1mol FeCl3完全水解生成NA个胶体粒子
B. 常温常压下,23g NO2分子总数小于0.5NA
C. 标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D. 6.8g熔融态KHSO4中含有0.1NA个阳离子
4.下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③沸点:H2Se>H2S>H2O ④结合H能力:OH>CH3COO>I
A.①③ B.②③ C.①④D.②④
3++---5.V mL Al2(SO4)3溶液中含有Ala g,取
-12V mL溶液稀释到4V mL,则稀释后溶液中S044的物质的量浓度是( )
A.125a125a125a125amol/L B.mol/L C.mol/L D.mol/L 9V18V36V54V
6.下列说法不正确的是 ( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A.①④B.①④⑤ C.①②③④ D.①②③④⑤
7.室温下,下列各组离子能大量共存的是 ( )
A.稀硫酸中:K、Mg 、AlO2、S2O3
B.Na2S溶液中:SO4、K、Cl、Cu 2-+-2++2+-2-
Kw-13-13++2+2-C.=10mol·L溶液中:Fe、NH4、Mg、 SO4?c(H)
D.通入大量CO2的溶液中:Na、ClO、CH3COO、HCO3
8.下列离子方程式书写正确的是 ()
A.过量的CO2通入NaOH溶液中:CO2+2OH = CO3 +H2O
B.氨水中通入过量CO2:2NH3·H2O + CO2 = 2NH4 + CO3 + H2O
C.饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca+HCO3+OH=CaCO3↓+H2O
D.NaHCO3溶液中加入过量的Ca(OH)2溶液:
2HCO3 +Ca+2OH = CaCO3↓+2H2O+CO3
9.下列物质的制备方法正确的是 ( )
A.氯化铝溶液和硫化钠溶液反应制备Al2S3B.用镁粉和空气反应制备Mg3N2
C.用铝粉和MnO2制得锰 D.用电解熔融氯化铝的方法制得单质铝
10.一未完成的离子方程式:________+XO3+6H===3X2+3H2O,据此判断下列说法
正确的是( )
A.X原子最外层有5个电子
B.当有1molX2生成时,共有2mol电子转移
C.氧化产物和还原产物的物质的量之比为5∶1
D.“_____”上所填的微粒和XO3在任何环境下都不能共存
11.将两粒相同大小的钠,一粒用铝箔包好为甲,另一粒为乙,将甲、乙两粒钠分别投入足
量的水中,收集所得气体,气体的体积大小关系是 ( )
A.甲多B.乙多C.一样多D.无法确定
12.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3
③NaHSO3④Na2S,所含带电微粒的数目由多到少的顺序是( )
A.①=④>③=②
C.①>④>③>② B.①=④>③>② D.④>①>③>② --+-2+-2-2+——+2—-2-+---
13.已知NH4CuSO3与足量的10mol/L硫酸液混合微热,有下列现象:①有红色金属生成 ②
产生刺激性气味的气体 ③溶液呈现蓝色。下列说法正确的是( )
A、反应中硫酸作氧化剂B、NH4CuSO3中硫元素被氧化
C、刺激性气味的气体是氨气 D、1molNH4CuSO3完全反应转移0.5mol电子
14.含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的
( )
量与生成沉淀的物质的量的关系正确的是(离子或物质)沉淀pH见下表)
15
1 mol·L,现向其中加入0.96 g 铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224 mLB.168 mL C.112 mL D.448 mL
16.在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到
的沉淀物是
A.Fe2S3、I2 B.Al(OH)3、I2( ) C.Fe(OH)3、Al(OH)3 D.FeS、S、Al(OH)3 -1
17.下列有关说法正确的是( )
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.反应A(g)2B(g);若正反应的活化能为Ea kJ·mol,逆反应的活化
-1-1-1能为Eb kJ·mol,则该反应的△H =(Ea -Eb)kJ·mol。
C.N2(g)+3H2(g)
氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发
进行,则该反应的ΔS <0
18.将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的
适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为:
A. 9 B.10 C.11D.12 ( )
19.控制适合的条件,将反应Fe+Ag3+2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时 Fe+Ag2++ 设计成如
图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计
的0刻度居中,左右均有刻度)。已知接通后观察到电流计
指针向右偏转。下列判断正确的是
( )
A.盐桥中的K移向乙烧杯
B.一段时间后,电流计指针反向偏转,越过0刻度,向左
边偏转
C.在外电路中,电子从石墨电极流向银电极
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
20.可逆反应mA(g)+nB(g) +pC(g)+qD(g)的v-t图像如图甲所示,若其他
条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分
面积相等 ⑧图乙中阴影部分面积更大. 以上所述正确的为( )
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦D.②④⑤⑧
21.设某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,且X > 11将上述两溶液分别取等体积
充分混合,混合液中各离子的浓度由大到小的顺序是 ( )
A.c(Cl)?c(NH4)?c(H)?c(OH) -++-B.c(NH4)?c(Cl)?c(H)? c(OH) +-+- C.c(NH4)?c(Cl) ?c(OH)?c(H) +---+ D.c(Cl)? c(NH4)?c(OH)? c(H) -++
22.某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应:
A(g)+B(g) C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见
下表,下列说法正确的是( )
-1B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大
于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,
反应达到平衡前v(正)<v(逆)
23.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确
的是 ( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa;c.NaHCO3;d.NaOH.?其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(
Na)
?2c(SO4)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为?2?Ka?Kh?Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.③⑤⑥
mol·L盐酸,溶液
-1 B.③④⑥ -1C.④⑤⑥ D.①②④ 24. 室温下,向20.00 mL 1.000 mol·L氨水中滴入1.000
pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法错误的是( )
102(a?14)
mol.L?1 A.室温下,a点的氨水电离常数为(a?14)1?10
B.将此氨水稀释,溶液的导电能力减弱
C.c点时消耗盐酸体积V(HCl)<20 mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
25.将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解
( )
A.4.48L B.5.6L C.6.72L D.7.84L
II卷(包含4道大题, 共45分)
二. 填空
26.(9分)已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A
是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。
(1)F的俗名是,B分子的结构式为________工业上利用反应③生
产。
(2)反应④的离子方程式为。
(3)有一种单质能与H反应生成E,该反应的化学方程式为 。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反
应的离子方程式为 。
27.(7分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是________________ 、 ______________ ______、_____________________________。
(分别用化学用语表示,下同)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的
是 。
(4)物质的量之和为0.01mol的二种粒子是__________________________。
(5)和 两种粒子数量之和比OH多0.008mol
28.(14分)(1)在一定温度下,向1L体积固定的密闭容器中加入1molA
(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的
变化如图所示。 0—2min内的平均反应速率v(A)=. 相同温
度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时是
原来的2倍。
a.平衡常数 b. A的平衡浓
d.平衡时B的体积分数e.平衡时混合气体的密度
f .平衡时混合气体的平均摩尔质量
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡移动(填“向
-一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体在标准状况的体积为